新規審査を例に、審査申請の流れを説明します。ここでは概要を示しておりますので、
詳細は学校法人日本医科大学における特定臨床研究に関する手順書をご確認ください。
審査申請の流れ(図)
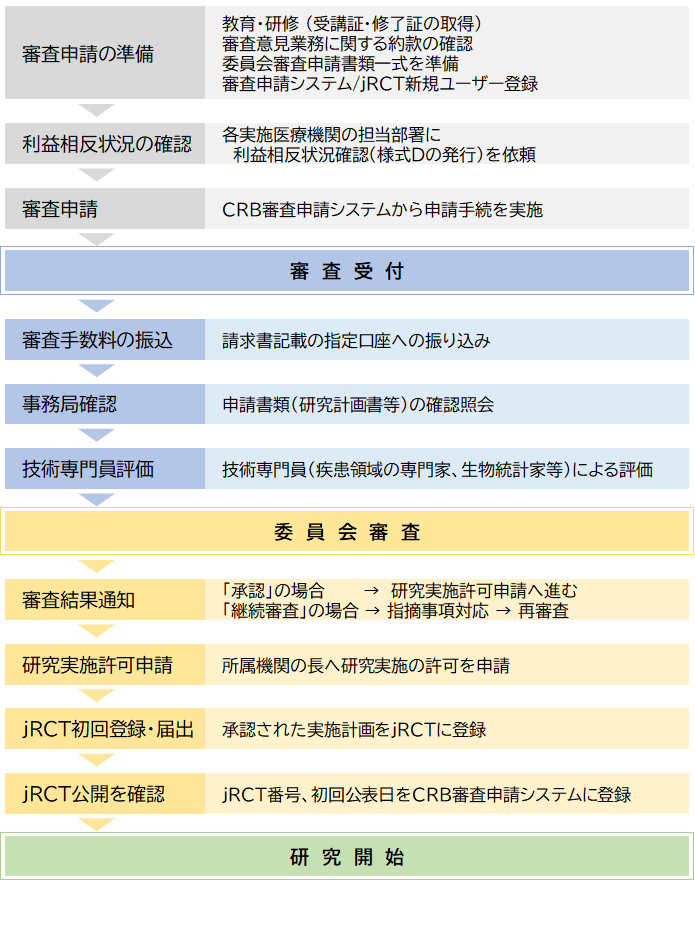
0. 審査申請の準備
統括管理者は研究計画書および同意・説明文書を作成するとともに、
委員会申請に必要な書類の一式を準備してください。
・教育・研修
・臨床研究法に基づく臨床研究等を実施する全ての教職員等は、研究対象者や被験者の
・安全や倫理面に十分配慮して研究を適正に実施するために、教育、訓練をうけること
・が義務付けられています。
・学内研究者の場合、手続きについては下記のページをご参照ください。
・審査意見業務に関する約款
・審査申請の前に、必ず下記の「審査意見業務に関する約款」をお読みください。
・ご同意の上で、審査申請を行ってください。
・ひな型
・研究計画書や同意・説明文書のひな型を用意しております。
学内研究者向け手順書・ひな型
・計画された臨床研究が特定臨床研究に該当するかどうかに関しては、
厚生労働省の特定臨床研究の該当性に関するチェックリストをご確認ください。
・各審査区分に必要な書類
・提出書類チェックシート をご確認ください。
・当委員会が指定する様式は次の通りです。
※▼をクリックすると、審査区分の項目が展開されます。
※審査区分の項目をクリックすると、書類(ZIPファイル)がダウンロードできます。
・臨床研究審査委員会申請システム
・臨床研究審査委員会申請システム (BV Clinical-CRB)にて申請受付等をしております。
・本委員会に初めて申請をされる方は、システムのユーザー登録をお願いいたします。
・臨床研究等提出・公開システム(jRCT)
・厚生労働大臣に対して、実施計画の提出等の届出手続を行なうためのシステムです。
・初めて申請をされる方は、登録者アカウント新規登録をお願いいたします。
1.利益相反状況の確認
研究責任医師・研究分担医師等が所属する機関による利益相反状況確認が必要です。
本学の利益相反マネジメント委員会へ、別途申請を行う必要があります。
手続きの方法は各実施医療機関の担当部署にご確認ください。
| ≪利益相反管理様式の作成方法≫ 簡単に作成手順をまとめています。記載例もあわせてご活用ください。 特定臨床研究の利益相反状況確認に関する手順書ver.1.1 利益相反管理様式(記載例) |
2.審査申請
全ての審査書類が整いましたら、審査申請システムから審査申請を行ってください。
申請完了後、3営業日以内に審査書類受領の連絡がない場合は、ご連絡ください。
3.審査手数料の振込み
審査書類を受領後、事務局より審査手数料の見積書及び請求書を郵送いたします。
見積書、請求書が届きましたら、原則2週間以内に請求書に記載された銀行口座へ審査手数料をお振込みください。
※ 2週間以内のお振込みが困難な場合は事務局までご一報ください
※ 詳細については、こちらをご確認ください。
4.事務局確認
審査書類を受領後、事務局にて審査書類の確認を行います。
追加・修正等が必要な場合は申請者又は事務担当者にメールにてご連絡いたします。
5.技術専門員評価
技術専門員が審査書類を科学的観点から考察し、技術専門員評価書を作成します。
提出された評価書は、事務局から申請者又は事務担当者にご連絡いたします。
※ 新規審査 :技術専門員の評価書が必須となります。
※ 新規審査以外:必要に応じて求められる場合があります。
| 技術専門員とは
認定臨床研究審査委員会から依頼をうけ、評価書を用いて科学的観点から意見を述べる専門家をいいます。 ・審査意見業務の対象となる疾患領域の専門家 |
6.委員会審査
事務局にて審査書類の確認、審査手数料の振込の確認等を行い、追加・修正が必要な場合は申請者にメールで連絡します。
受付締切日までに審査書類が提出されたものの、書類不備により資料が揃わない場合には、委員会審査が次回以降となることがありますのでご注意ください。
- 《新規申請の場合》
- 委員会開催日に出席していただき、研究概要の説明と質疑応答を
お願いいたします。 - Webexシステムでのオンライン参加も可能です。
- ※新規審査以外の審査であっても、委員会出席を依頼する場合があります。
- ※詳細はお問い合わせください。
7.審査結果通知書発送
委員会で審議終了後、審査結果通知書を発送します。
・原則、委員会開催日から1週間以内に審査結果通知書を発行します。
・止むを得ない事情により、審議結果通知書の発行が遅れる場合があります。
8.実施許可申請
委員会が研究の実施を承認した場合には、所属機関の長に実施許可申請を行い、
研究実施の許可を取得してください。
手続きの方法は各実施医療機関の担当部署にご確認ください。
<新規申請の場合>
実施許可の取得=研究開始ではありません!
必ず下記の手続きを行なってから研究を開始してください。
<変更申請・定期報告等の場合>
委員会審査承認ごとに、実施許可の取得が必要です。
9. 厚労省への届出(jRCT登録)
実施許可を取得した後、臨床研究等提出・公開システム(jRCT)を経由して、
承認された研究の新規登録を行なってください。
届出が受理されると、jRCT上に実施計画番号(jRCT番号)、初回公表日等の研究情報が公開されます。
jRCT番号、初回公表日を審査申請システムに登録して、研究を開始してください。
なお、研究を開始するまでには、原則として臨床研究保険の加入が必要となります。
◇ お問い合わせ先
- 学校法人日本医科大学 臨床研究審査委員会事務局
- E-mail:officetokutei★nms.ac.jp
(★を@にしてご利用ください) - TEL :03-3822-2131(内線5910,5911)
- FAX :03-3868-9159
- ADD :〒113-8602 東京都文京区千駄木1-1-5


