※このページでは、統括管理者が研究責任医師を兼ねる場合の実施許可申請の手続き
※について、その概要を説明しております。それ以外の場合など、詳細については、
※「特定臨床研究の実施許可手続きに関する手順書」をご確認ください。
特定臨床研究を実施しようとする統括管理者は、臨床研究審査委員会の審査・承認を得たうえで、次の手続きを経て、特定臨床研究を開始することが出来ます。
(1)実施医療機関の管理者に対する実施許可の申請
(2)実施医療機関の管理者による実施許可の承認
(3)厚生労働省(地方厚生局)への実施計画の届出
(4)jRCTによる研究内容の情報公開
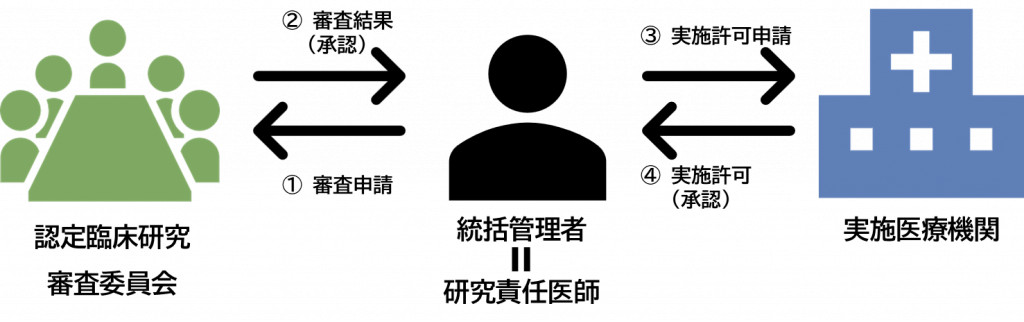
学校法人日本医科大学臨床研究審査委員会による承認を受けた特定臨床研究は、「①審査申請」を審査申請システム(BV Clinical-CRB)上で実施しているため、「③実施許可申請」の申請画面が審査申請システム上で自動作成されます。
※ 審査申請システムの詳細・申請方法については
「学校法人日本医科大学における特定臨床研究に関する手順書」をご確認ください。
1. 実施許可申請区分(本学CRBで審査を受けた場合)
| 審査申請区分 | CRB 審査 |
実施 許可 |
jRCT 届出 |
備考 | ||
|---|---|---|---|---|---|---|
| 新規申請 | 〇 | 〇 | 〇 | |||
| 変更申請 | 〇 | 〇 | △* | *実施計画の変更を伴う場合、必要 | ||
| 軽微変更通知 | 不要 | 不要 | 〇* | *jRCTで軽微変更届後、CRBに報告 | ||
| 定期報告 | 〇 | 〇 | 〇 | |||
| 疾病等報告 | 〇 | 〇 | △* | *報告の内容によってPMDA報告も必要 | ||
| 重大な不適合報告 | 〇 | 〇 | 不要 | |||
| 不適合報告 | 不要 | 不要 | 不要 | 病院長報告のみ | ||
| 中止通知 | 〇 | 〇 | 〇 | |||
| 終了通知 | 〇 | 〇 | 〇 | |||
| その他報告 | △ | △ | △ | 内容による | ||
2.審査申請システムでの実施許可申請手続
申請書類が整いましたら、申請システムから実施許可申請を行なってください。
不適合報告の実施許可申請は管理者報告のみのため、委員会審査は不要です。
実施許可申請の手順については、下記区分より選択してください。
 をクリックすると、手順書のPDFが展開されます。
をクリックすると、手順書のPDFが展開されます。本学CRBで承認された特定臨床研究の実施許可申請
他機関CRBで承認された特定臨床研究の実施許可申請
<新規申請の場合>
・実施許可書の取得=研究開始ではありません。
・実施許可書の取得後、下記 jRCTの届出処理 を行い、実施計画番号(jRCT
・番号)が付与・公開されたことを確認してから、研究を開始してください。
・手順を踏まずに研究を開始すると、臨床研究法違反になります。
<新規申請以外>
・以下の審査区分の場合もjRCTの届出が必要です。
・変更申請(実施計画の変更を伴う場合)
・定期報告、中止届、終了届
・疾病等報告(予期しない重篤な疾病等の場合)
3. 実施許可申請に必要な書類
| 特定-様式2 | 臨床研究に関する実施許可申請報告書 | 全ての審査申請区分に共通 |
|---|---|---|
| 特定-様式3 | 臨床研究に関する承認書 | 実施医療機関が作成 |
| 特定-様式4 | 不適合報告書 | 病院長報告に使用する |
臨床研究に関する実施許可申請報告書
・研究名称/所属受付番号/jRCT番号/研究責任医師名を入力してください。
・統括管理者について、研究責任医師と同一かどうか選択してください。
・当該研究の審査を担当する委員会を選択してください。
・「実施許可申請」する区分を選択し、必要に応じて備考欄に記載してください。
・提出資料がある場合、必要に応じて添付資料一覧に記載してください。
4.実施許可担当部署
各所属機関にて実施許可申請の窓口は以下の通りです。
| 所属機関 | 所属担当部署 | メールアドレス (★を@にしてご利用ください) |
|---|---|---|
| 日本医科大学 付属病院 及び関連施設 |
臨床研究総合センター | tokutei-nmshp.group★nms.ac.jp |
| 日本医科大学 武蔵小杉病院 |
治験管理事務局 | tiken★nms.ac.jp |
| 日本医科大学 多摩永山病院 |
治験事務室 | nagayama-chiken_center★nms.ac.jp |
| 日本医科大学 千葉北総病院 |
治験推進室 | hokusoh-clinicaltrial★nms.ac.jp |
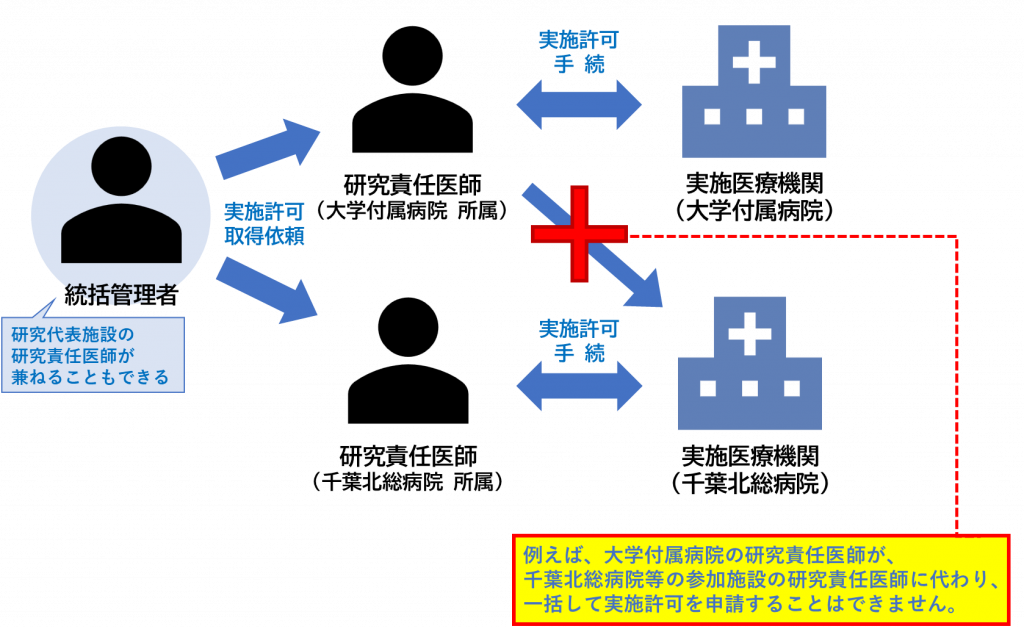
臨床研究法における実施許可は、それぞれの研究責任医師が、ご自身の所属する実施医療機関の長にそれぞれに申請する必要があります。
実施許可の一括審査はできませんので、ご注意ください。
<例>
研究代表施設が大学付属病院である特定臨床研究に、武蔵小杉病院、多摩永山病院および千葉北総病院がそれぞれ研究分担施設として参加する場合には、各病院の研究責任医師は、自身の所属する病院の病院長に対して、それぞれに実施許可申請を行う必要があります。