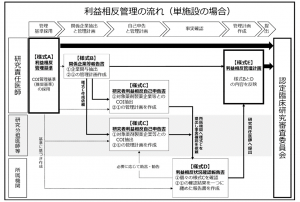
研究責任医師(多機関共同研究の研究代表施設の場合は、研究代表医師)は、自身の研究に関する医薬品等製造販売業者等(関係企業等)を抽出し、関係性を整理して利益相反状況を管理する必要があります。また、その手順については、標準的な利益相反管理の手順が厚生労働省から提示されております。
| ▶ 「臨床研究法における利益相反管理について」 |
研究責任医師(多機関共同研究の研究代表施設の場合は、研究代表医師)は、作成した様式Aと様式Eを認定臨床研究審査委員会に提出する必要があります。
1. 利益相反状況の確認時期
| 利益相反確認依頼が必要となるとき |
|---|
|
|
|
|
2. 利益相反状況の確認時に提出する書類
| 書類名 | 備考 |
|---|---|
| 利益相反状況確認依頼書 (特定様式1)※1 |
<書類> こちらからダウンロード可能です。 <様式C> 利益相反申告者※4 の人数分必要です。 |
| 研究分担医師リスト (統一書式1)※2 |
|
| 利益相反管理様式(様式A~C)※3 | |
| 研究計画書 | 最新版の研究計画書、説明文書・同意文書をご提出ください。 ※新規申請の場合はドラフト版を提出 |
| 説明文書・同意文書 |
※1 利益相反状況確認依頼書(特定様式1)
・本学の利益相反状況確認依頼の際に作成・提出が必要となる学内様式です。
・利益相反状況の確認時期(記載例)にあわせて、申請区分をご選択ください。
※2 研究分担医師リスト(統一様式1)
・臨床研究法にて研究責任医師の使用が推奨されている書式です。
・臨床研究法を実施する全ての実施医療機関、認定臨床研究審査委員会で
・使用できます。
| ▶ 「参考:「臨床研究法の統一書式について」 |
※3 利益相反管理様式(様式A~C)
・利益相反管理様式の詳細についてはこちらをご覧ください。
・利益相反管理様式の作成手順についてはこちらをご覧ください。
・利益相反管理様式(記載例)についてはこちらをご覧ください。
※4 利益相反申告者とは
・研究代表医師/研究責任医師/研究分担医師
・統計解析責任者
・臨床研究を実施することによって利益を得ることが明白な者
3.利益相反状況の確認依頼先(所属担当部署)
各所属機関にて利益相反状況の確認依頼の窓口は以下の通りです。
研究責任医師は、上記(2)に記載の書類を用意し、部署長の承諾を得た後、
所属担当部署に書類を提出してください。
| 所属機関 | 所属担当部署 | メールアドレス (★を@にしてご利用ください) |
|---|---|---|
| 付属病院 他関連施設 |
臨床研究総合センター | tokutei-nmshp.group★nms.ac.jp |
| 武蔵小杉病院 | 治験管理事務局 | tiken★nms.ac.jp |
| 多摩永山病院 | 治験事務室 | nagayama-chiken_center★nms.ac.jp |
| 千葉北総病院 | 治験推進室 | hokusoh-clinicaltrial★nms.ac.jp |
4.定期報告時の利益相反状況確認の簡略化
定期報告時に限り、以下の条件がすべて満たされる場合、利益相反状況確認の一部プロセスを簡略化することができます。
▶詳細は こちら
◇ お問い合わせ先
-
- 学校法人日本医科大学 臨床研究審査委員会事務局
- E-mail:officetokutei★nms.ac.jp
(★を@にしてご利用ください) - TEL :03-3822-2131(内線5910,5911)
- FAX :03-3868-9159
- ADD :〒113-8602 東京都文京区千駄木1-1-5


